Оценка электрокоагуляции и термодиффузии после rf-микроигл с использованием модели кожи свиньи in vivo
Опубликовано несколько исследований, в которых изучалась роль радиочастотного микроигольчатого воздействия (RFMN) в электрокоагуляции кожи. В этом исследовании использовалась свиная модель, чтобы изучить доставку биполярной энергии через кожу с помощью устройства RFMN.
ЦельЦелью этого исследования было изучение и сравнение теплового воздействия на кожу при использовании устройства RFMN, генерирующего сигналы с амплитудой 1 и 2 МГц, с соответствующими градиентами напряжения и тока, с использованием неизолированных и изолированных игл путем изучения гистологических эффектов на кожу свиней.
МетодыБыли проведены два отдельных исследования на животных для оценки эффектов электрокоагуляции и термодиффузии с использованием устройства RFMN. Эффекты электрокоагуляции оценивали гистологически с окрашиванием гематоксилином и эозином (H&E), а эффекты нагрева оценивали с помощью тепловизионного изображения.
РезультатыРезультаты гистологического исследования теплового повреждения в результате воздействия изолированными иглами показали, что воздействие с частотой 2 МГц приводили к формированию узкой и концентрированной зоны коагуляции в сравнении с 1 МГц. Кроме того, изолированная игла с частотой 1 МГц вызывала коагуляцию ткани в форме овала в сравнении со столбчатой коагуляцией ткани с частотой 2 МГц. Наконец, полная термодиффузия происходит через несколько секунд после воздействия радиочастотным излучением заданной продолжительности.
ВыводРезультаты показали, что воздействие изолированной иглой с частотой 1 МГц вызывает более крупную площадь коагуляции с увеличением уровня мощности, эффект от воздействия неизолированной иглой с частотой 1 МГц был сопоставим с воздействием изолированной иглой с частотой 2 МГц с аналогичными гистологическими характеристиками, а тепло рассеивается через несколько секунд после воздействия в течение заданного времени.
Радиочастотные (РЧ) устройства и лазеры в настоящее время используются для фотоомоложения и лечения рубцов на лице. При фотоомоложении и лечении рубцов важно избегать или минимизировать термическое повреждение эпидермиса, чтобы сократить время простоя и избежать возникновения поствоспалительной гиперпигментации (PIH) или гипопигментации. Радиочастотное воздействие позволяет игнорировать эффект от эпидермального меланина, в то время как оптические лазеры работают по принципу селективного фототермолиза. Было доказано, что радиочастотный метод является предпочтительным в сравнении с абляционными лазерами, когда удается избежать значительной реабилитации и повреждения эпидермиса.
Радиочастотные устройства отличаются от лазеров тем, что в них применяется колеблющийся электрический ток, тогда как в лазерах используется электрический ток для возбуждения электронов в газе, кристалле или стекле для излучения света. Радиочастотные устройства могут передавать однополярную или биполярную энергию. Однополярный радиочастотный сигнал включает два полюса, при этом один полюс представляет собой отрицательную пластину заземления, а другой полюс — пластину аппликатора, которая задает радиочастотное воздействие. Монополярная РЧ энергия используется, когда требуется большая глубина проникновения и более высокий объемный нагрев, что важно для контурирования тела и растворения жира. Биполярное РЧ-устройство включает два или более активных электрода, где один электрод положительный, а другой отрицательный. Микроиглы являются электродами для радиочастотного микроигольчатого воздействия (RFMN). Биполярная РЧ энергия имеет преимущество перед монополярной, потому что термическое повреждение может быть ограничено определенным слоем кожи по сравнению с монополярной РЧ, которую сложнее контролировать. Биполярное РЧ-воздействие предпочтительно, когда требуется точность и бережное отношение к эпидермальному и подкожному слоям. Это необходимо при коррекции признаков фотостарения лица.
Коммерческие устройства RFMN отличаются друг от друга размещением игл в различных геометрических конфигурациях, изменением количества игл в матрице, использованием различных изолирующих материалов для игл для контроля диффузии радиочастотной энергии, использованием неизолированных игл для эффекта радиочастотного воздействия, углом игл и управлением радиочастотной энергией для контроля глубины воздействия на ткань.
В этом исследовании гистологически и термически изучалось распространение радиочастотного излучения при использовании изолированных и неизолированных игл с использованием свиной модели с заданной глубиной, заданным временем радиочастотного воздействия, заданным уровнем мощности и на частотах 1 и 2 МГц.
МетодыДва протокола исследования были одобрены Институциональным комитетом по уходу за животными (IACUC), после чего исследования были проведены в соответствии с утвержденными руководящими принципами.
Исследование 1В исследовании 1 использовались две самки йоркширских свиней с массой тела 46-47 кг, которые прошли акклиматизацию в течение 1 недели. Йоркширские свиньи были выбраны из-за их размера, учитывая необходимость изучения площади поверхности тела в местах применения RFMN. Животные были приобретены у одобренного поставщика и акклиматизированы в соответствии со стандартными условиями содержания в течение 5 дней до начала исследования. Клинические наблюдения, включая все отклонения, регистрировались один раз в день во время акклиматизации, чтобы подтвердить здоровье животного для исследования. Воздействие RFMN (Vivace; SHENB Co., Ltd.; Рисунок 1) выполняли на спине свиньи с помощью набора квадратных игл размером 6 × 6, которые проникали в дерму. Животным производили анестезию посредством внутримышечного введения тилетамина и золазепама с поддержкой анестезии посредством смеси изофлюрана с кислородом. Затем животных помещали в положение лежа на боку и воздействовали на правую тыльную сторону. Кожу в области грудной клетки и на спине обрили и обработали. Сетки размечали несмываемыми чернилами для обозначения мест применения устройства. Каждая область воздействия представляла собой матрицу из 36 микроигл с заданными радиочастотными параметрами: изолированная или неизолированная микроигла, уровень мощности, глубина, время воздействия радиочастотной энергией и частота 1 или 2 МГц. Значения напряжения и силы тока для каждого уровня мощности приведены в таблице 1. Каждое место воздействия было расположено на расстоянии 1 см друг от друга, чтобы исключить радиочастотное и тепловое воздействие от соседних областей. В общей сложности на каждом животном было выполнено 56 воздействий.
Через час после каждой процедуры из каждого места введения иглы брали биопсию на глубину 3-5 мм. Набор игл представляет собой микроиглы 10 × 10 мм с диаметром 0,3 мм, расстояние между иглами составляет 1,67 мм. Также были взяты контрольные биопсии из необработанных участков. Биоптаты из обработанных и необработанных участков кожи фиксировали в 10% нейтральном забуференном формалине (NBF), заливали парафином, а затем окрашивали гематоксилином и эозином (H&E). После подготовки образцы ткани из обработанных и необработанных участков анализировали с применением инструмента для цифрового анализа изображений ImageJ (NIH, 2018), сравнивая площади участков коагуляции.
Площадь коагуляции оценивали после биполярного радиочастотного воздействия с использованием изолированной и неизолированной микроиглы на частоте 1 и 2 МГц. На изображениях участков электрокоагуляции (рис. 2А) оценивали цвет, оттенок, насыщенность, яркость (HSB) с красным пороговым цветом и методом порогового значения ImageJ по умолчанию (рис. 2B). После выделения выбирали контрольное изображение, а затем выполняли анализ площади для определения начального значения площади (рис. 2C). Затем инструмент выбора использовали для дальнейшего выделения области коагуляции для количественного измерения площади (рис. 2D).
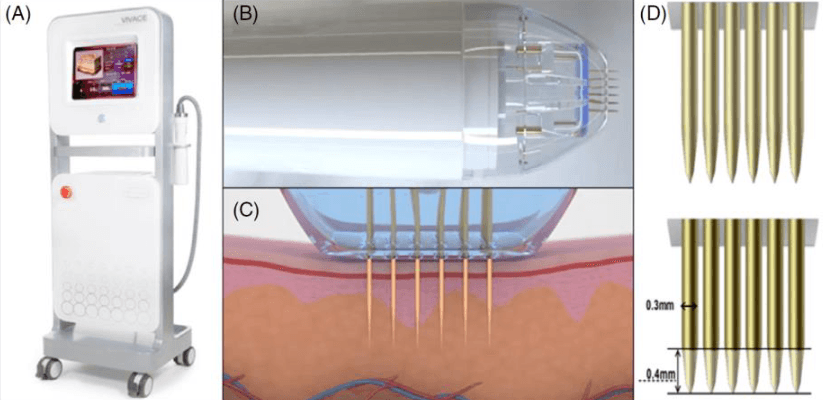
Рисунок 1. Устройство RFMN. А: Конструкция устройства. B: Наконечник с прикрепленным картриджем для микроигл, вид сбоку. C: Картридж с микроиглами с иглами, введенными в слой кожи. D: Неизолированные микроиглы (вверху) и изолированные микроиглы (внизу).
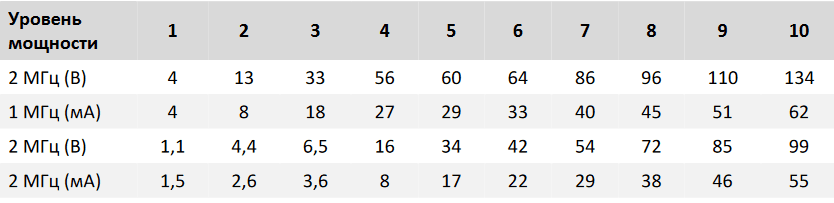
Таблица 1. Напряжение (В) и сила тока (мА) системы RFMN в зависимости от уровня мощности.
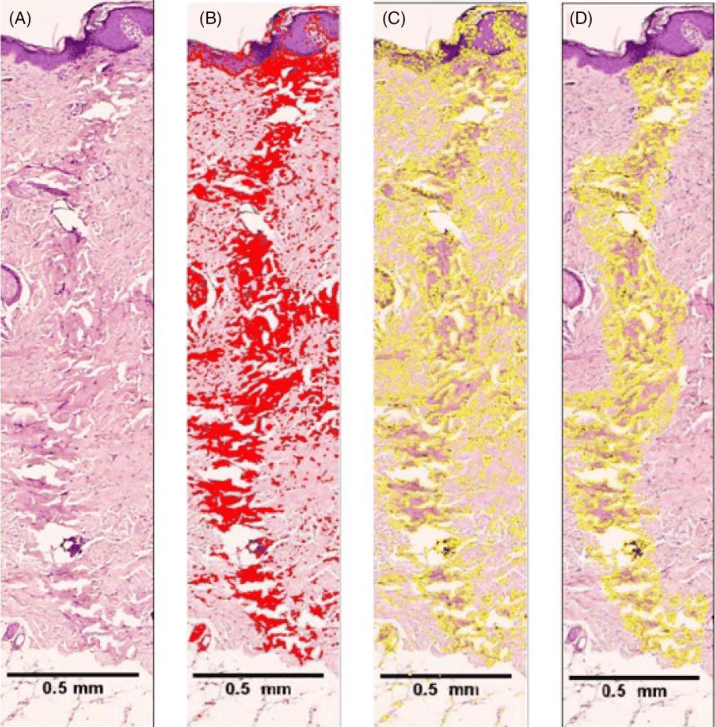
Рисунок 2. Методика обработки изображений для анализа площади неоднородных форм с использованием ImageJ. A: Гистологическая картина ткани после воздействия устройством RFMN. B: Пороговый цвет для отображения электрокоагуляции. C: Необработанные материалы, выбор порогового цвета. D: Электрокоагуляция с уменьшением шума для анализа площади.
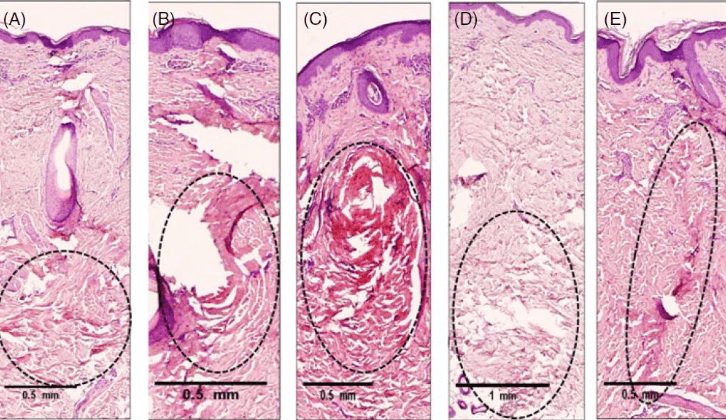
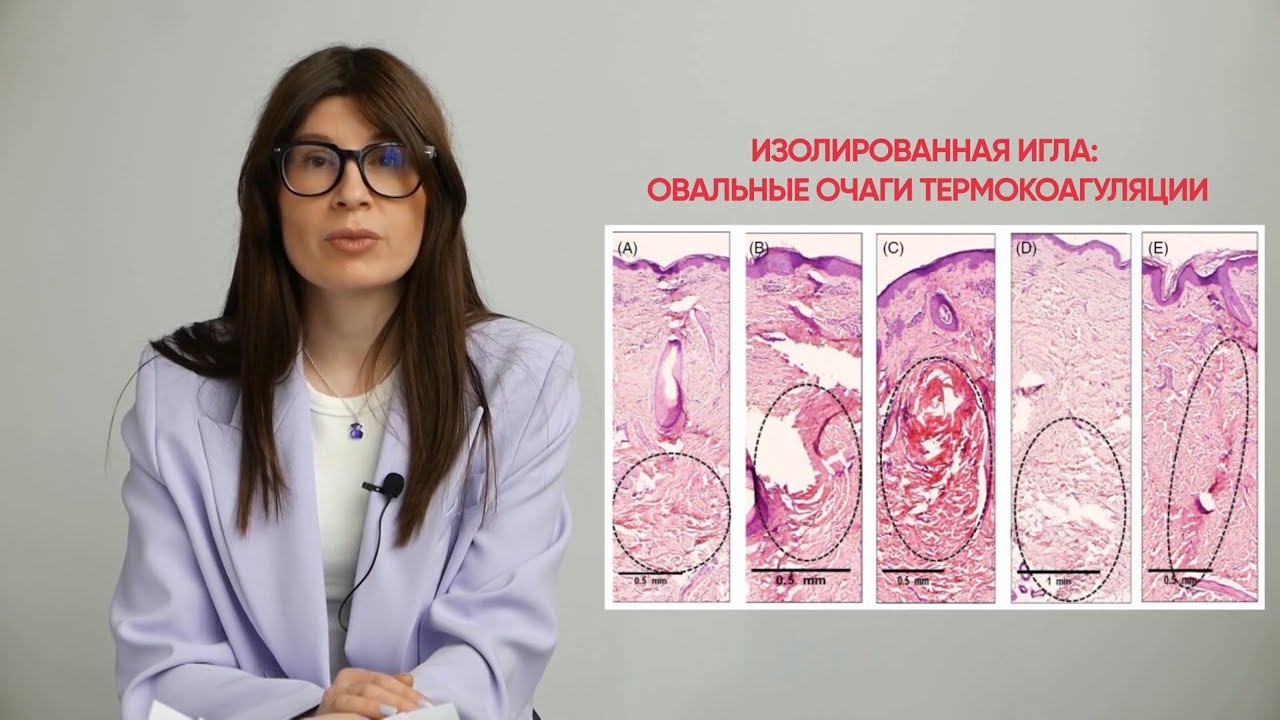
Рисунок 3. Реакции тканей после воздействия биполярной радиочастотной (РЧ) энергией с частотой 1 МГц с использованием изолированных микроигл на коже свиньи in vivo. На коже свиньи определялось термическое повреждение дермы, вызванное радиочастотным излучением с заданными параметрами — 1 МГц, инвазивное биполярное РЧ-воздействие, уровень мощности 4(A), 5(B), 6(C), 7(D), 8(E), время воздействия 600 мс, глубина проникновения 2 мм с использованием электрохирургического микроигольного устройства.
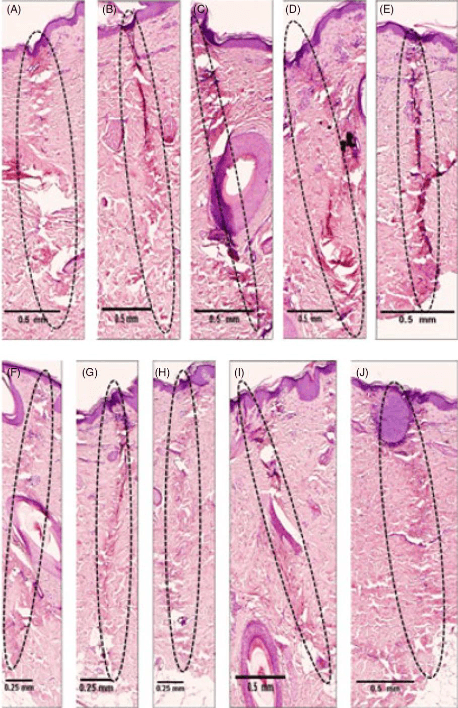
Рисунок 4. Реакции тканей после биполярного радиочастотного воздействия с частотой 2 МГц с использованием изолированных микроигольных электродов (A-E) и инвазивного биполярного радиочастотного воздействия с частотой 1 МГц с использованием неизолированных микроигольных электродов (F-J) на коже свиньи in vivo. Отмечались сходства результатов термального повреждения кожи свиней при использовании изолированного микроигольного РЧ-электрода с частотой 2 МГц в сравнении с неизолированным микроигольный РЧ-электродом с частотой 1 МГц в дерме с заданными параметрами — 2 МГц (A-E) и 1 МГц (F-J) инвазивное биполярное РЧ-воздействие, уровень мощности 4(A, F), 5(B, G), 6(C, H), 7(D, I), 8(E, J), время 600 мс, глубина проникновения 2 мм с использованием электрохирургического микроигольного устройства.
2.2 | Исследование 2
Также было проведено тепловизионное исследование с использованием трех юкатанских карликовых свиней с массой тела около 20 кг. Юкатанских карликовых свиней выбрали для исследования из-за размера, так как для исследования не требовалось большой площади поверхности, как в исследовании 1. Животные были приобретены у одобренного поставщика и акклиматизированы в соответствии со стандартными условиями содержания в течение 5 дней до начала исследования. Клинические наблюдения, включая все отклонения, регистрировались один раз в день во время акклиматизации, чтобы подтвердить здоровье животного для исследования.
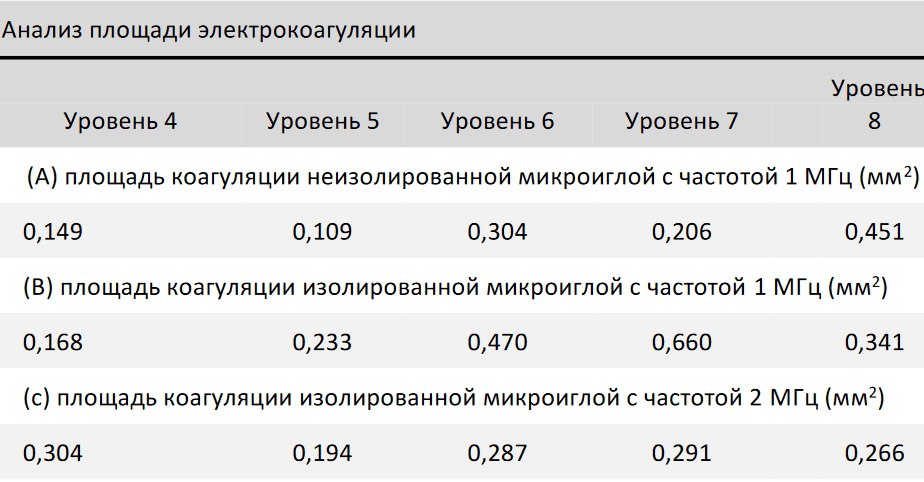
Таблица 2. Анализ площади электрокоагуляции. A: Зона коагуляции с применением неизолированной микроиглы с частотой 1 МГц; B: Зона коагуляции с применением изолированной микроиглы с частотой 1 МГц; C: Зона коагуляции с применением изолированной микроиглы с частотой 2 МГц; зона коагуляции с применением неизолированной микроиглы с частотой 2 МГц не показана в таблице из-за того, что коагуляция не заметна при гистологическом анализе.
Животным производили анестезию посредством внутримышечного введения тилетамина и золазепама с поддержкой анестезии посредством смеси изофлюрана с кислородом. Животных укладывали в положение лежа на брюхе. На спине формировали кожный лоскут размером 10 × 10 см и поднимали его к средней линии. Животное укладывают в положение лежа на боку таким образом, чтобы кожный лоскут был отведен параллельно столу, чтобы систему тепловизионной визуализации (FLIR A325 sc) можно было расположить под поверхностью лоскута для определения эффектов термодиффузии после воздействия RFMN. Затем, по мере необходимости, формировали дополнительные лоскуты вдоль спины, если предыдущий лоскут было невозможно использовать после обработки. Толщину кожного лоскута каждый раз измеряли штангенциркулем на проксимальном, медиальном и дистальном участках, чтобы убедиться, что исходные кожные лоскуты были одинаковыми по размеру. Регистрировали толщину, а также оптимизировали глубину. Иглу вводили на глубину 1 мм от нижней части кожного лоскута. Глубину иглы регулируют за счет измерения толщины кожного лоскута. Использовали следующую формулу:
Толщина кожного лоскута (мм) − 1 мм = Глубина введения иглы. Для достижения гемостаза по краям кожного лоскута производили каутеризацию. Каутеризацию не выполняли внутри очерченной зоны, где производили воздействие RFMN. Воздействие RFMN выполняли на поверхности эпидермиса. Когда иглы полностью проникли в дерму, производили регистрацию видео. Затем видео экспортировали и фильтровали с помощью программного обеспечения MATLAB (The MathWorks Inc), предоставленного FLIR, США, для получения чистого изображения для контроля эффекта нагрева после воздействия системы RFMN.
3 | РЕЗУЛЬТАТЫ
Гистологический анализ образцов кожи свиньи подтвердил коагуляционное термическое повреждение в месте введения иглы. На гистологических изображениях (рисунки 3A-E и 4A-J) в эпидермисе было обнаружено место проникновения иглы, очерченное фокальной областью более темного фиолетового цвета, но заметные повреждения эпидермиса, если таковые имеются, отсутствовали.
Анализ площади термического повреждения выявил положительную корреляцию с амплитудой сигнала с частотой 1 МГц, когда увеличение мощности приводило к увеличению площади коагуляции (таблица 2). Результаты гистологического исследования теплового повреждения в результате воздействия изолированными иглами (рисунки 3А-Е и 4А-Е) показали, что воздействие с частотой 2 МГц приводили к формированию узкой и концентрированной зоны коагуляции в сравнении с 1 МГц.
Изолированные иглы покрыты материалом так, что 0,4 мм длины иглы остаются неизолированными (рис. 1D). Это позволяет энергии излучаться из неизолированной части, при этом большая часть ее проходит вниз по изолированному стержню к наконечнику иглы. Напротив, неизолированная игла (рис. 1D) обеспечивает большее рассеивание энергии по всей длине иглы. Гистологические исследования показали, что использование изолированной иглы с частотой 2 МГц может вызвать коагуляцию ткани со схожими гистологическими изменениями в сравнении с неизолированной иглой с частотой 1 МГц (рис. 4A-J). При сравнении коагуляции изолированными иглами с частотой 1 МГц (рис. 3А-Е) и изолированными иглами с частотой 2 МГц (рис. 4А-Е) изолированная игла с частотой 1 МГц вызывала коагуляцию ткани в форме овала в отличие от столбчатой коагуляции ткани на частоте 2 МГц.
3.3 | Оценка тепловой диффузии радиочастотной микроиглы
Системы радиочастотных микроигл обеспечивают доставку энергии к определенному слою кожи, производя электрокоагуляцию, как было показано ранее на рисунках 2 и 3. На рисунке 5 описана тепловая диффузия при использовании системы RFMN под инфракрасной (ИК) камерой в идеальной системе. На рисунке 6 показан другой результат, когда ИК-камера фиксирует равномерный блок рассеивания радиочастотной энергии. Кроме того, на рисунке 6 показано, что, хотя максимальное время радиочастотной проводимости в системе составляет 800 мс, эффект нагрева не достигает максимума до 10 секунд.
4 | ОБСУЖДЕНИЕ
Было опубликовано несколько исследований, в которых изучалось влияние радиочастотной электрокоагуляции на эпидермальные ткани и дерму, причем большинство отчетов было представлено описанием клинических случаев. Правильный выбор частоты, мощности и игл для RFMN имеет решающее значение для успешной процедуры.
Для RFMN важно свести к минимуму термическое повреждение эпидермиса, чтобы уменьшить дискомфорт пациента и время простоя. В текущем исследовании устройство для RFMN не выявило каких-либо повреждений эпидермиса при использовании изолированных или неизолированных микроигл с частотой 1 или 2 МГц. На частоте 1 МГц площадь коагуляции была больше, чем на частоте 2 МГц. Это может быть связано с большей длиной волны на частоте 1 МГц в сравнении с 2 МГц, что позволяет проходить через покрытые микроиглы току большего напряжения и с большим градиентом плотности, увеличивая расстояние действия эффекта микрокоагуляции. Площадь коагуляции менялась в меньшей степени при более высокой мощности, что подтверждает площадь коагуляции изолированной иглы с частотой 2 МГц в таблице 2. Эти результаты подтверждают наблюдения в предыдущих исследованиях, в которых на коагуляцию значительно влияли глубина микроиглы и время проводимости радиочастотного излучения. Электрокоагуляция также подвержена вариабельности из-за биоимпеданса или сопротивления ткани-мишени при использовании радиочастотного метода.

Рисунок 5. Снимки с оценкой температуры под ИК-камерой в области размещения электродов системы RFMN. A: После воздействия радиочастотных импульсов продолжительностью 800 мс. B: Через несколько секунд после развития эффекта рассеивания тепла. C: Тепловые зоны при использовании системы RFMN.

Рисунок 6. Тепловые изображения области воздействия с использованием изолированных микроигольных электродов и продолжительности воздействия радиочастотных микроимпульсов 800 мс и уровне мощности 10. (A) 1 с, (B) 2 с, (C) 8 с и (D) 10 с.
Причина, по которой электрокоагуляция неизолированной иглой с частотой 1 МГц и изолированной иглой с частотой 2 МГц имеет схожие гистологические результаты (рис. 4), может быть связана с дисперсией частоты в изоляционном материале изолированной иглы. Это новое открытие повышает полезность радиочастотных микроигл, позволяя пользователю переключаться между изолированными и неизолированными иглами с изменяющимися частотами, что предоставит врачу больший контроль над коагуляцией тканей без необходимости переключения игл. Таким образом, изолированная игла предоставляет больше возможностей для лечения в сравнении с неизолированной иглой.
Теплопередача происходит при воздействии RFMN на определенный слой кожи. При высокой мощности между нагретой иглой и тканью возникает проводимость, между нагретой иглой и кровью и другими жидкостями в коже возникает конвекция, а излучение происходит с радиочастотной дисперсией, и при этом не требуется среда переноса. Все эти методы теплопередачи приводят к единому нагреву в сравнении с периодическим неравномерным нагревом, как показано на рисунке 4. На рисунке 4 предполагается, что тепло передается только за счет проводимости между иглами и тканью. Это исследование показало, что теплопередача от микроигл более сложна, и опровергло предположение на рисунке 4. Следовательно, исследуемый метод RFMN обеспечивает равномерную диффузию тепла, когда тепло рассеивается и заполняет всю площадь микроиглы (рис. 6), а не неравномерную диффузию тепла, когда нагрев не заполняет всю площадь микроиглы (рис. 5).
Несмотря на то, что исследуемое устройство RFMN осуществляет нагрев «единым блоком» или равномерный нагрев, устройство по-прежнему вызывает столбчатую или овулярную электрокоагуляцию, а не электрокоагуляцию равномерным блоком. Это может быть связано с тем, что проводимость (а не конвекция и излучение) оказывает наибольшее влияние на теплопередачу. При анализе воздействия RFMN на кожу важно учитывать конвекцию и излучение. Конвекция и излучение все еще могут играть ключевую роль в ремоделировании внеклеточного матрикса из-за их нагревательного эффекта, показанного на рисунке 6. Нагрев единым блоком или равномерный нагрев, показанный на рисунке 6, демонстрирует, что тепло ограничивается областью матрицы микроигл и снижает проблемы, связанные с безопасностью при использовании радиочастотных устройств.
Поскольку полная тепловая диффузия происходит через несколько секунд после радиочастотного воздействия в течение заданного времени, важно знать о возможном объемном нагреве или повреждении от объемного нагрева, что, в свою очередь, может привести к повреждению эпидермиса и/или нагреву подкожного слоя. Такое объемное тепловое повреждение нежелательно из-за меньшего контроля зоны нагрева и потенциальных побочных эффектов для пациента.
Несмотря на то, что образцы кожи свиньи отличаются от образцов кожи человека, это лучшая альтернатива в случаях, когда для биопсии требуются большие площади поверхности. Мы считаем, что теперь, когда нам известно об эффектах радиочастотной диффузии при использовании RFMN, это может помочь врачам оптимизировать условия лечения пациентов и помочь направлять дальнейшие исследования в области RFMN на пути оптимизации клинических испытаний с уменьшением количества биопсий благодаря результатам представленных исследований.
5 | ВЫВОДЫ
В этом исследовании были представлены характеристики структурных изменений в коже свиней при биполярном радиочастотном воздействии с использованием изолированных и неизолированных игл с частотой 1 и 2 МГц. Результаты указывают, что изолированная игла с частотой 1 МГц создает большие области электрокоагуляции по мере увеличения уровня мощности. Изолированная игла с частотой 2 МГц вызывает такие же гистологические изменения, как и неизолированная игла с частотой 1 МГц. Наконец, это исследование также продемонстрировало, что радиочастотное тепло рассеивается через несколько секунд после воздействия в течение заданного времени, что требует соблюдения осторожности при наложении или укладке массивов микроигл для предотвращения объемного нагрева.